近期,吉林大学第一医院器官再造与移植教育部重点实验室、人类疾病动物模型国家地方联合工程实验室、未来科学国际合作联合实验室转化免疫学团队在CELL子刊Cell Reports Medicine发表题为“Expression of a mutant CD47 protects against phagocytosis without inducing cell death or inhibiting angiogenesis”的研究工作。该研究通过用GPI膜锚取代CD47分子跨膜和胞内结构域,构建一种CD47突变体(CD47-IgV),该突变体的转基因表达可抑制巨噬细胞的吞噬作用,但不诱导细胞死亡或抑制血管生成。
CD47分子在细胞表面广泛表达,作为信号调节蛋白α(SIRPα)的配体,通过激活SIRPα传递免疫抑制信号,抑制巨噬细胞的吞噬作用及DC和NK细胞活化,在先天性和适应性免疫反应中起着重要调节作用。肿瘤细胞过表达CD47是肿瘤细胞免疫逃逸的重要机制,因此CD47/SIRPα信号通路被证明是肿瘤免疫治疗的一个重要靶点。但是,本团队和其他团队的研究结果证明CD47在移植免疫中表现出两面性特点。一方面,巨噬细胞介导的异种移植免疫排斥主要由物种间CD47和SIRPα的不相容性导致,因此使供体细胞表达与宿主SIRPα相容的CD47可有效抑制异种移植排斥;过表达CD47也可抑制同种异体移植免疫排斥反应,为制备低免疫原性多能干细胞提供有效方案,促进干细胞在再生医学中的应用。另一方面,CD47过表达也会带来一系列的潜在不利影响,CD47被其配体(如TSP-1和可溶性SIRPα)激活时可诱导细胞死亡、抑制血管生成和胰腺β细胞的胰岛素释放,加剧辐射和缺血再灌注损伤。因此,迫切需要开发改构的CD47分子,使其在保留CD47/SIRPa抑制功能的同时避免CD47过表达对细胞产生不利影响。
CD47的跨膜结构域和胞内结构域在CD47信号转导中起到关键作用,据此,本团队选取了一个糖基磷脂酰肌醇(GPI)膜锚分子,以该GPI连接信号序列取代跨膜和胞内结构域构建了一个CD47突变体。进一步通过体内外研究发现该CD47突变体(称为CD47-IgV)可以在细胞表面有效表达,并可抑制巨噬细胞的吞噬作用。与野生型(WT)CD47相比,CD47-IgV介导相同水平的免疫抑制作用,但不传递细胞死亡信号或抑制血管生成。此外,应用造血干细胞移植模型发现表达CD47-IgV不影响造血干细胞的植入效率或谱系分化功能。因此,CD47-IgV提供了一种过表达CD47的有效改良方法,对抑制异种移植排斥和制备低免疫原性多能干细胞有重要意义,具有临床转化价值。(图一)
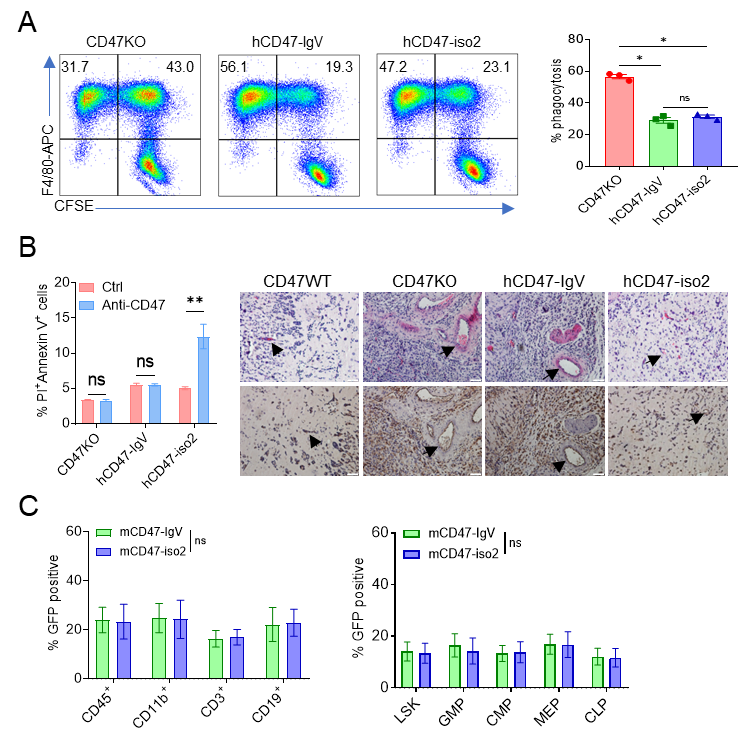
图一:(A)CD47-IgV有效抑制巨噬细胞吞噬,(B)不诱导内皮细胞死亡、促进血管生成,(C)不影响造血干细胞功能
相关的研究成果近期发表在Cell Reports Medicine上,文章第一作者为吉林大学博士生徐璐,通讯作者为吉林大学杨永广教授。
全文链接:https://doi.org/10.1016/j.xcrm.2024.101450