近期,吉林大学未来科学国际合作联合实验室、器官再造与移植教育部重点实验室、第一医院人类疾病动物模型国家地方联合工程实验室科研团队在Acta Pharmaceutica Sinica B上发表题为“Optimized Lipid Nanoparticles Enable Effective CRISPR/Cas9-Mediated Gene Editing in Dendritic Cells for Enhanced Immunotherapy”的研究工作。该研究强调了脂质纳米颗粒内胆固醇密度的重要性,揭示了其对树突状细胞(DC)基因编辑效率的调控作用。该策略为癌症免疫疗法带来了新希望,为治疗免疫相关疾病提供了一条新途径。
免疫疗法已成为一种前景广阔的治疗手段,为肿瘤等多种免疫相关疾病的治疗开辟了新天地。DC细胞作为专职抗原递呈细胞,具有独特的捕获、处理和向T细胞提呈抗原的能力,在启动和调节免疫反应中发挥着关键作用。因此,DC细胞成为免疫治疗的一个潜在靶点。CRISPR/Cas9基因编辑技术的出现为免疫疗法中精准基因调控开辟了新途径。利用基因编辑技术调节DC细胞基因表达对于调控DC细胞的功能至关重要。然而,如何将基于CRISPR的疗法精确递送到DC细胞仍是一项重大挑战。尽管脂质纳米颗粒(LNPs)已广泛用于肿瘤细胞的基因编辑,但其在DC细胞基因调控的研究仍相对较少。这可能是由于DC细胞中核酸酶活性导致核酸药物的快速降解,从而阻碍了CRISPR/Cas9系统在这些细胞内的功能发挥。因此,有效递送Cas9 mRNA至DC细胞并随后将其表达为Cas9蛋白,是在DC细胞中成功实现基因编辑的关键步骤。胆固醇是脂质纳米颗粒中一个重要的组分,能够维持颗粒结构的稳定,然而脂质纳米颗粒中胆固醇对mRNA递送以及基因编辑效率的影响尚不完全明确。
本文研究人员以BAMEA-O16B可电离脂质为基础,构建了不同胆固醇密度的脂质纳米颗粒(BLAN)。体外实验表明,BLAN中胆固醇密度影响DC细胞中mRNA表达,且胆固醇密度与mRNA表达呈负相关。mRNA分子量和胆固醇密度均不影响BLAN中mRNA的装载能力,但会调控不同分子量mRNA的释放。对于大分子量的mRNA(如Cas9 mRNA),不同胆固醇密度的BLAN在释放Cas9 mRNA方面无显著差异。然而,对于小分子量的mRNA(如RFP mRNA),不同胆固醇密度的BLAN释放mRNA的能力不同。结果显示,低胆固醇密度的BLAN具有最高的mRNA释放速率,而高胆固醇密度的BLAN释放mRNA的速度最慢。此外,低胆固醇密度的BLAN递送的Cas9 mRNA和sgRNA能够更高效的被DC细胞摄取,且内涵体逃逸能力更强,从而更有效地对DC细胞进行基因编辑(图一)。
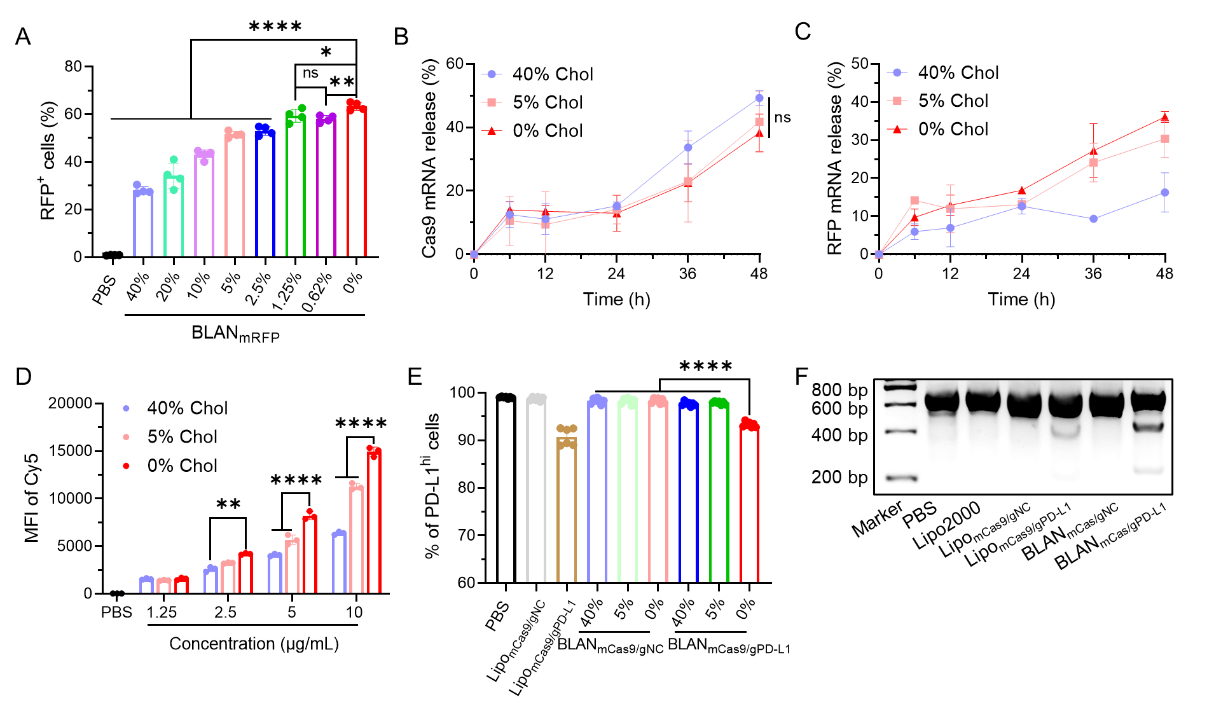
图一:BLAN中胆固醇含量调控DC细胞中mRNA表达和释放
在体内实验中,将优化后的BLAN注射到荷瘤小鼠体内,可以更高效地被肿瘤微环境以及引流淋巴结中的DC细胞摄取,有效敲除DC细胞上PD-L1的表达,促进引流淋巴结中cDC1的富集、增强DC细胞活化和成熟,提高T细胞介导的抗肿瘤免疫应答水平,显著抑制结肠癌的生长(图二)。
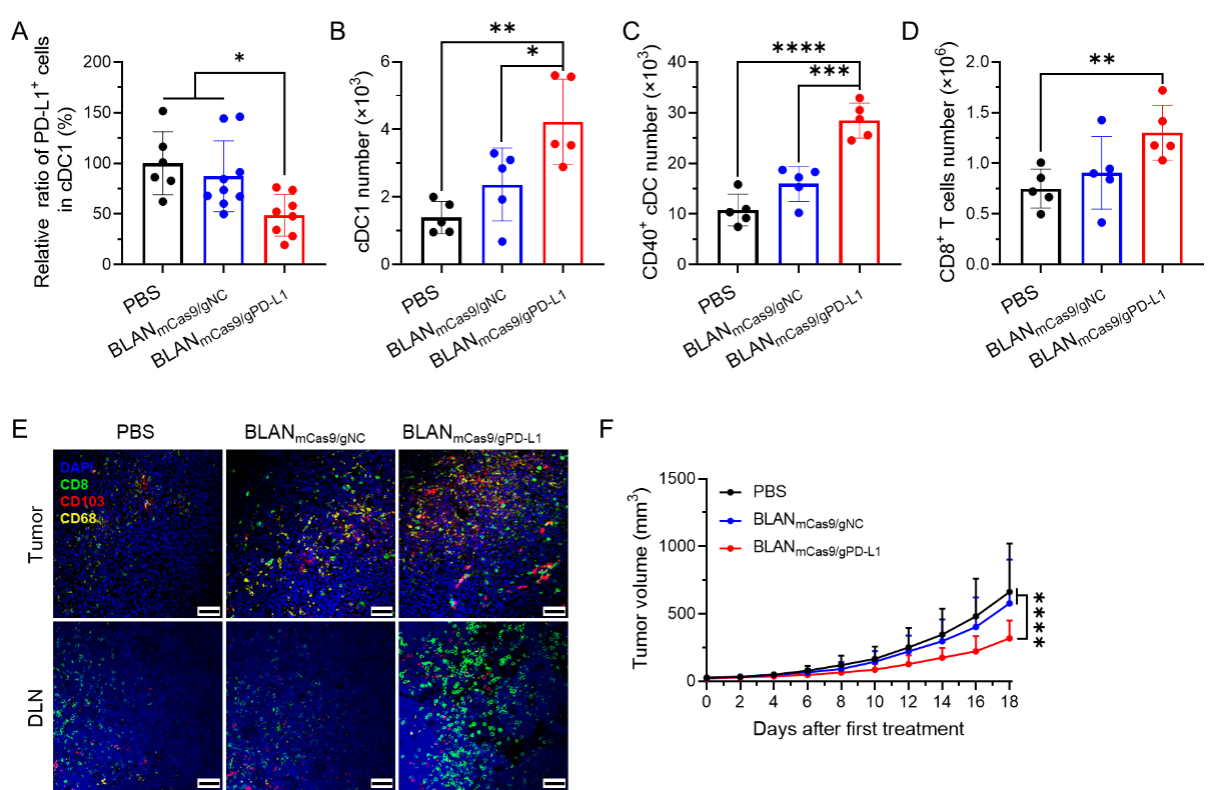
图二:优化的BLAN敲除DC细胞上PD-L1,增强抗肿瘤免疫应答
这项研究强调了在BLAN中优化胆固醇组分对增强DC细胞基因编辑的关键作用。该方法有效促进DC细胞活化,增强T细胞功能,从而显著提高抗肿瘤免疫应答。这些发现突显了利用BLAN作为智能递送系统将Cas9 mRNA和sgRNA递送至DC细胞以进行体内基因编辑的应用潜力。
相关的研究成果近期发表在APSB上,文章第一作者为吉林大学鼎新学者博士后毛奎荣,通讯作者为吉林大学孙天盟教授和杨永广教授。
全文链接:https://www.sciencedirect.com/science/article/pii/S2211383524003526