近期,吉林大学第一医院、未来科学国际合作联合实验室转化免疫学团队在Nature Communications上发表了题为“Structural Mechanism of BRD4-NUT and p300 Bipartite Interaction in Propagating Aberrant Gene Transcription in Chromatin in NUT Carcinoma”的研究工作。该工作在分子结构水平解析了BRD4-NUT双重结合p300在染色质上扩增基因转录的作用机制。
染色质组蛋白乙酰化是激活基因表达的重要驱动之一。p300/CBP是关键的组蛋白乙酰化转移酶,但令人费解的是,当p300/CBP到达染色质时,其通常处于一种“自我抑制”的蛋白结构构象,尚不具有乙酰化修饰组蛋白的催化活性。然而在肿瘤中,是什么“开关”机制启动了p300/CBP的活化,进而导致异常水平的组蛋白乙酰化和癌基因转录调控,研究人员尚不十分清楚。

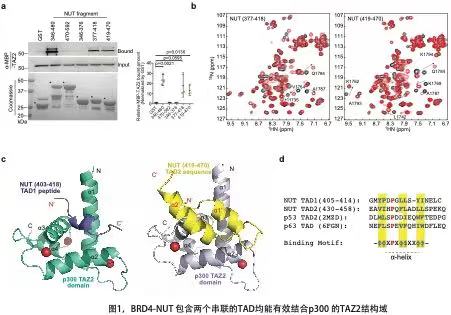
NUT癌(NC)一种罕见的高度侵袭性恶性肿瘤。由于NUT癌细胞中NUTM1基因重排,与配体基因BRD4等融合,形成一种致癌的BRD4-NUT融合蛋白,从而驱动p300/CBP激活所介导的组蛋白超乙酰化和基因表达紊乱。在该工作中,研究人员通过GST-pulldown(图1a)和核磁共振(NMR)亲和力滴定实验(图1b),首次发现BRD4-NUT融合蛋白中的NUT部分包含了两个串联的反式激活域(TAD),其均能有效地结合p300蛋白的TAZ2结构域。研究人员利用NMR技术解析了TAZ2与BRD4-NUT中TAD多肽的蛋白质分子复合结构,发现TAD1和TAD2的结合基序,均形成a-螺旋折叠,并通过残基疏水基团之间的作用,结合到p300的四螺旋束TAZ2结构域中(图1c)。对比转录因子p53和p63结合p300的TAD关键氨基酸基序,BRD4-NUT的TAD1和TAD2作用机制和结合序列均呈保守一致(图1d),显示其功能上与转录因子的潜在相关性。
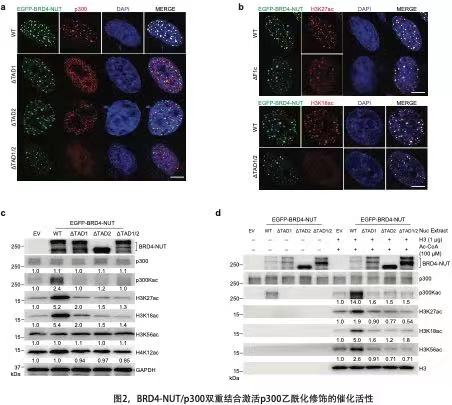
在细胞核内,融合蛋白BRD4-NUT能够与p300,组蛋白H3乙酰化赖氨酸K27ac和K18ac,转录辅助因子BRD4L和BRD4S形成液态共凝聚物(图2a、b)。然而,研究人员删除了BRD4-NUT中单个或者两个TAD后,发现删除突变体BRD4-NUT-DTAD1(或者-DTAD1、-DTAD1/2)明显降低与p300、H3K27ac和H3K18ac等在细胞核内的共凝聚(图2a、b),说明BRD4-NUT依赖于其串联TADs协同地双重结合p300,在形成共凝聚物的过程中发挥增强作用。通过细胞内(图2c)和体外乙酰化(图2d)实验,研究人员证实,野生型BRD4-NUT能够促进p300的自身乙酰化和自激活,并增加组蛋白赖氨酸乙酰化水平(图2c、d)。然而,如果删除单个或者串联的两个TAD,删除突变体BRD4-NUT-DTAD1(或者-DTAD1、-DTAD1/2)均未见增加p300催化活性和组蛋白乙酰化水平(图2c、d)。由于多种转录因子均包含进化上保守的两个串联TADs,因此研究人员进一步开展了转录因子p53的细胞内和体外乙酰化实验。他们发现,删除单个或者串联TAD后,突变体p53-DTAD1(或者-DTAD1、-DTAD1/2)未见增加p300自身乙酰化、p53乙酰化和组蛋白乙酰化水平。这些研究数据表明,BRD4-NUT中所包含的串联的TADs,在结合p300的TAZ2结构域时,形成a-螺旋折叠且可以分别作用两个p300分子。这种空间上双重协同结合p300可能改变了p300蛋白的TAZ2结构域自身抑制HAT结构域的空间构象,增加p300自身乙酰化水平,从而促进p300自身激活和组蛋白乙酰化,扩增基因转录调控。同样,转录因子p53通过串联TADs双重协同作用p300,能提高p300和p53自身乙酰化和激活,进而催化组蛋白乙酰化修饰。因此,这种以前缺乏认识的“开关”机制,基于BRD4-NUT双重结合及招募p300的活化模式,具有调控基因表达的广泛意义,为理解肿瘤细胞如何实现空间特异的基因激活机制提供了新方向。
相关的研究成果近期发表在Nature Communications杂志上,文章第一作者为吉林大学博士生喻笛和梁莹莹,通讯作者为吉林大学未来科学国际合作联合实验室曾雷教授和美国纽约市伊坎-西奈山医学院Ming-Ming Zhou教授。
全文链接:https://doi.org/10.1038/s41467-023-36063-5