近期,吉林大学未来科学国际合作联合实验室、吉林大学第一医院器官再造与移植教育部重点实验室、人类疾病动物模型国家地方联合工程实验室科研团队在Cell Reports上发表题为“IL-17A/CEBPβ/OPN/LYVE-1 Axis Inhibits Anti-Tumor Immunity by Promoting Tumor-Associated Tissue-Resident Macrophages”的研究工作。该研究揭示了IL17A/CEBPβ/OPN/LYVE-1轴是一种高度免疫抑制级联信号通路,并阐明了骨桥蛋白(osteopontin, OPN)分类调控肿瘤相关单核来源巨噬细胞和定居巨噬细胞免疫应答的新机制,对改进以肿瘤相关巨噬细胞为靶点的癌症免疫疗法具有重要意义。
肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)可以通过多种机制影响肿瘤进展,如抑制CD8+T细胞抗肿瘤免疫反应、诱导纤维化和促进血管新生等。大多数肿瘤组织中TAMs都是由定居巨噬细胞(Tissue-resident macrophage, TRM-TAMs)和单核细胞来源的巨噬细胞(Monocyte-derived macrophage, MDM-TAMs)组成的。不同发育来源的TAMs在肿瘤进展中发挥不同的功能,共同影响肿瘤的进展和预后。至今,因缺乏针对性而未在临床实践中取得令人满意的效果。因此,准确解析TAMs的组成及其调控机制,对于设计有效的靶向治疗方案至关重要。
IL-17A是由Th17细胞产生的一种标志性促炎细胞因子,在宿主防御病原体以及组织炎症中发挥着关键作用。因此,IL-17A已成为治疗各种自身性免疫疾病的药物靶点。然而,IL-17A在肿瘤微环境中普遍存在,发挥促肿瘤与抗肿瘤的双重作用,其背后的机制尚不明确,这为选择适合抗IL-17A抗体治疗的肿瘤患者带来了严峻挑战。在本研究之前,尚无关于TAMs与IL-17A之间直接关系的报道,且肿瘤细胞如何响应IL-17A的刺激并影响肿瘤微环境也未得到明确阐释。
为了探究IL-17A在TNBC进展中发挥的作用,作者首先检测了(Triple egative breast cancer, TNBC)患者的外周血和肿瘤组织中IL-17A浓度以及Th17细胞(主要产生IL-17A的细胞)的数量。结果发现TNBC患者外周血血清中IL-17A浓度明显增高,并且患者肿瘤组织中的IL-17A表达水平和Th17(RORγt+)细胞数量也明显增加。进一步发现抗IL-17A抗体(αIL-17A)治疗可明显抑制肿瘤生长、有效延长荷瘤小鼠存活时间。IL-17A支持肿瘤生长与促进TAMs数量增加有关。如果用氯膦酸二钠脂质体(Clodronate liposomes)消耗小鼠体内巨噬细胞,产生的抑制肿瘤生长效果与αIL-17A治疗效果接近,Clodronate liposomes联合αIL-17A治疗不能进一步提高αIL-17A的抗肿瘤效果(图一)。
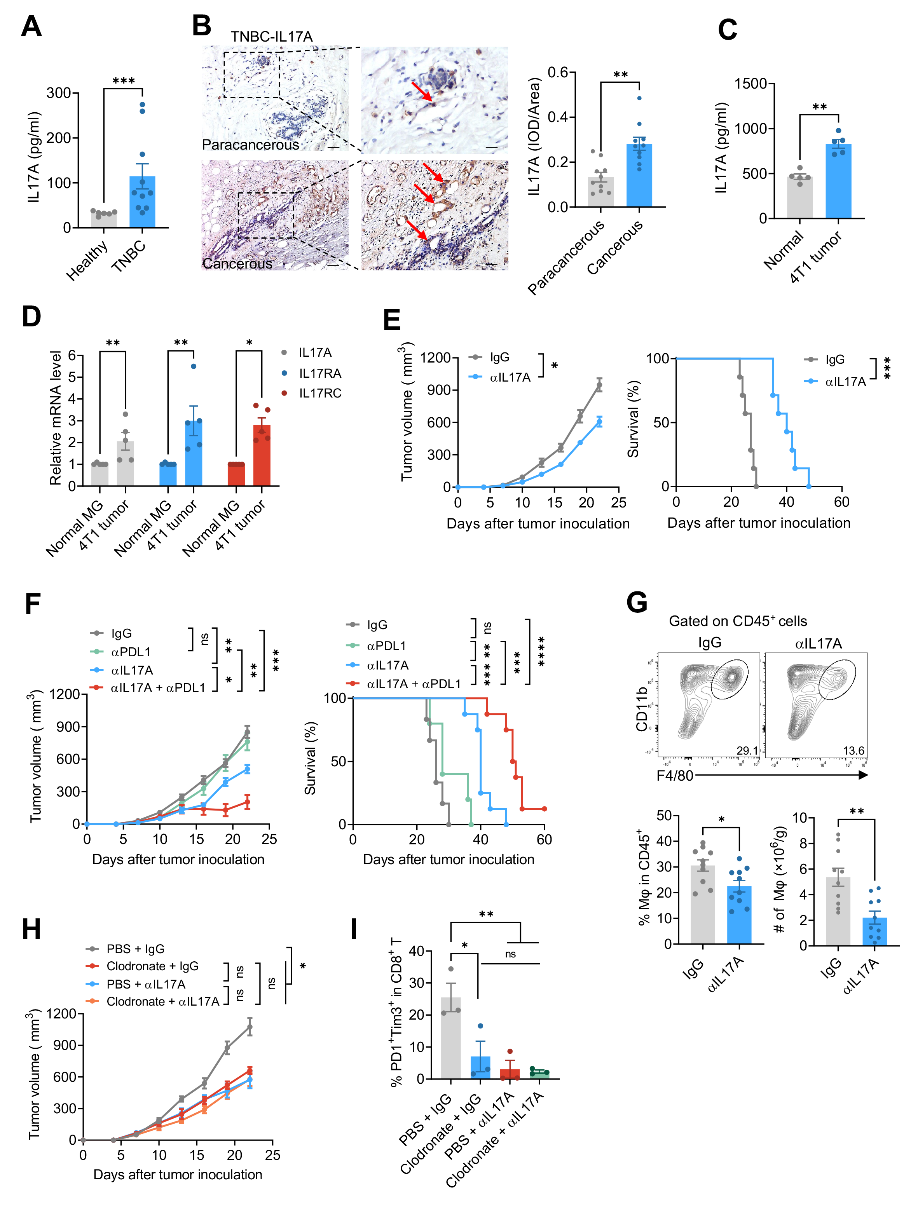
图一:IL-17A可以增加肿瘤组织中TAMs数量,促进肿瘤生长
为了探究IL-17A对TAMs调控机制,作者首先使用4T1Il17ra-KO或4T1Il17ra-KO肿瘤细胞构建了小鼠TNBC模型,发现肿瘤微环境中IL-17A主要是通过与肿瘤细胞上IL-17RA/RC结合激活肿瘤细胞的IL-17A信号通路进而发挥促肿瘤作用的。接下来,通过测序和一系列体内实验进一步明确了肿瘤细胞IL-17A/IL-17RA/RC信号通路下游效应分子OPN可以直接调控TAMs。肿瘤细胞产生的OPN可以诱导TAMs在肿瘤组织中富集。抑制肿瘤细胞的OPN表达可以阻碍肿瘤生长并减少M2型TAMs数量,宿主产生的OPN对肿瘤进展无明显作用(图二)。综上所述,作者详细阐明了肿瘤细胞产生并分泌OPN进而促进TAMs在肿瘤组织富集是IL-17A发挥促肿瘤效应的主要原因。
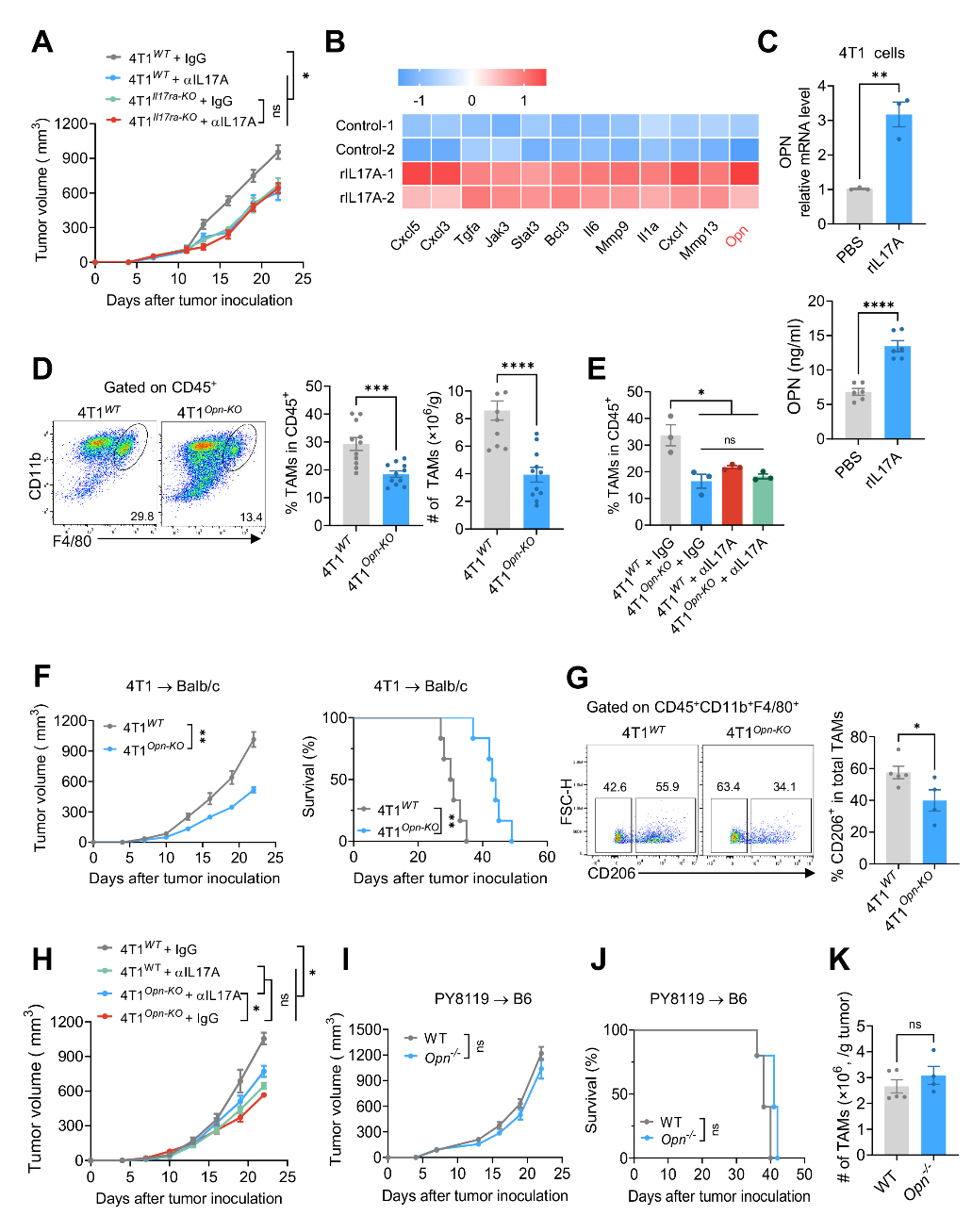
图二:IL-17A通过刺激肿瘤细胞产生OPN促进TAMs富集
接下来,作者发现肿瘤细胞中IL-17A-IL17RA/RC信号通路下游效应分子CEBPβ是调控OPN表达的关键转录因子(图三)。
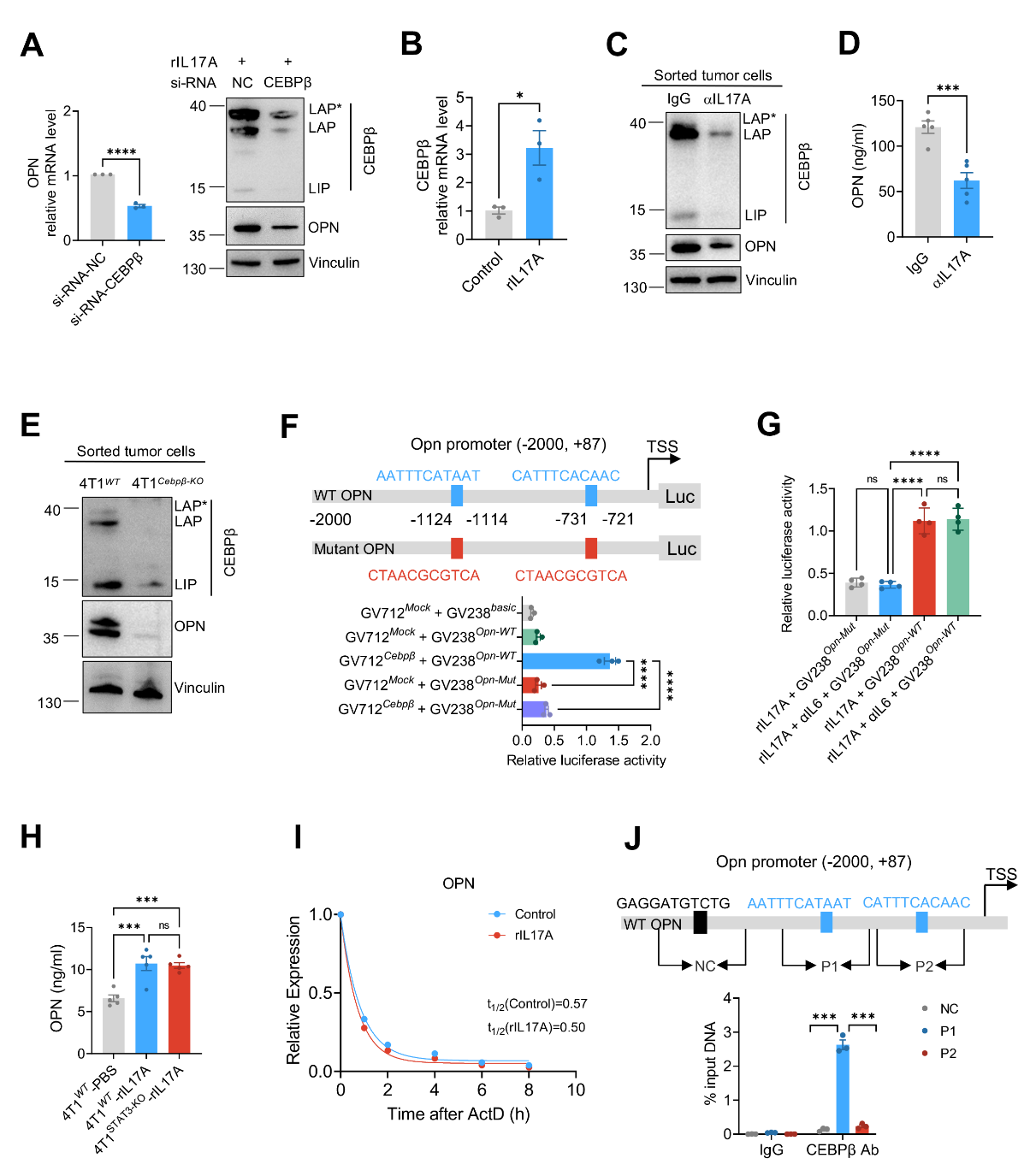
图三:IL-17A/CEBPβ轴调控肿瘤细胞产生OPN
进一步,作者揭示了OPN分别调控MDM-TAMs和TRM-TAMs的机制。首先证明了LYVE-1可以作为区分MDM-TAMs和TRM-TAMs的特异性标志物。然后发现OPN通过与α4β1整合素结合促进具有抗肿瘤免疫应答潜能的LYVE-1-MDM-TAM向肿瘤组织迁移(图四)。
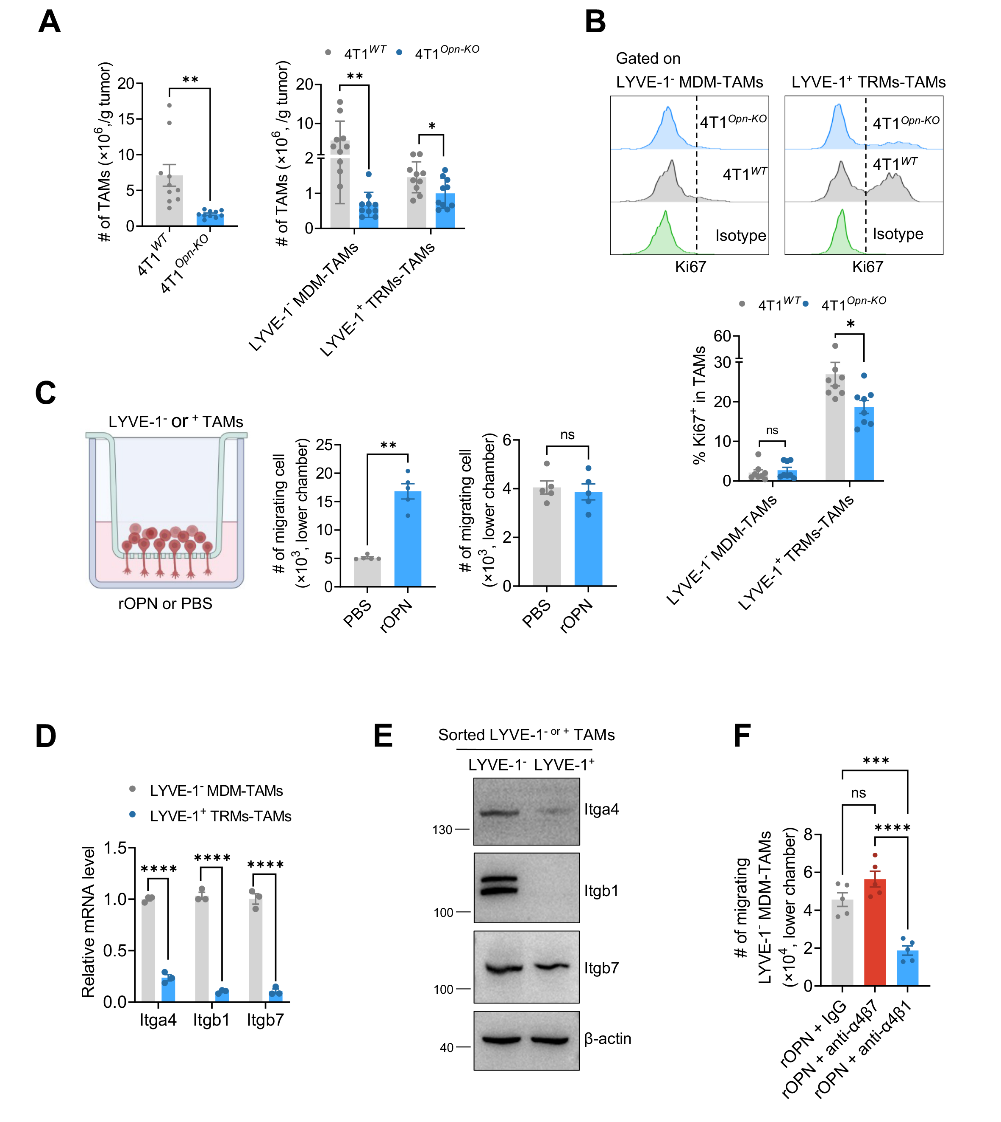
图四:OPN通过与α4β1整合素结合增强LYVE-1-MDMs-TAMs迁移
同时,发现了LYVE-1是OPN的新受体,OPN通过与LYVE-1结合激活JNK/c-jun信号通路、促进具有高度免疫抑制作用的LYVE-1+TRM-TAM大量增殖(图五)。
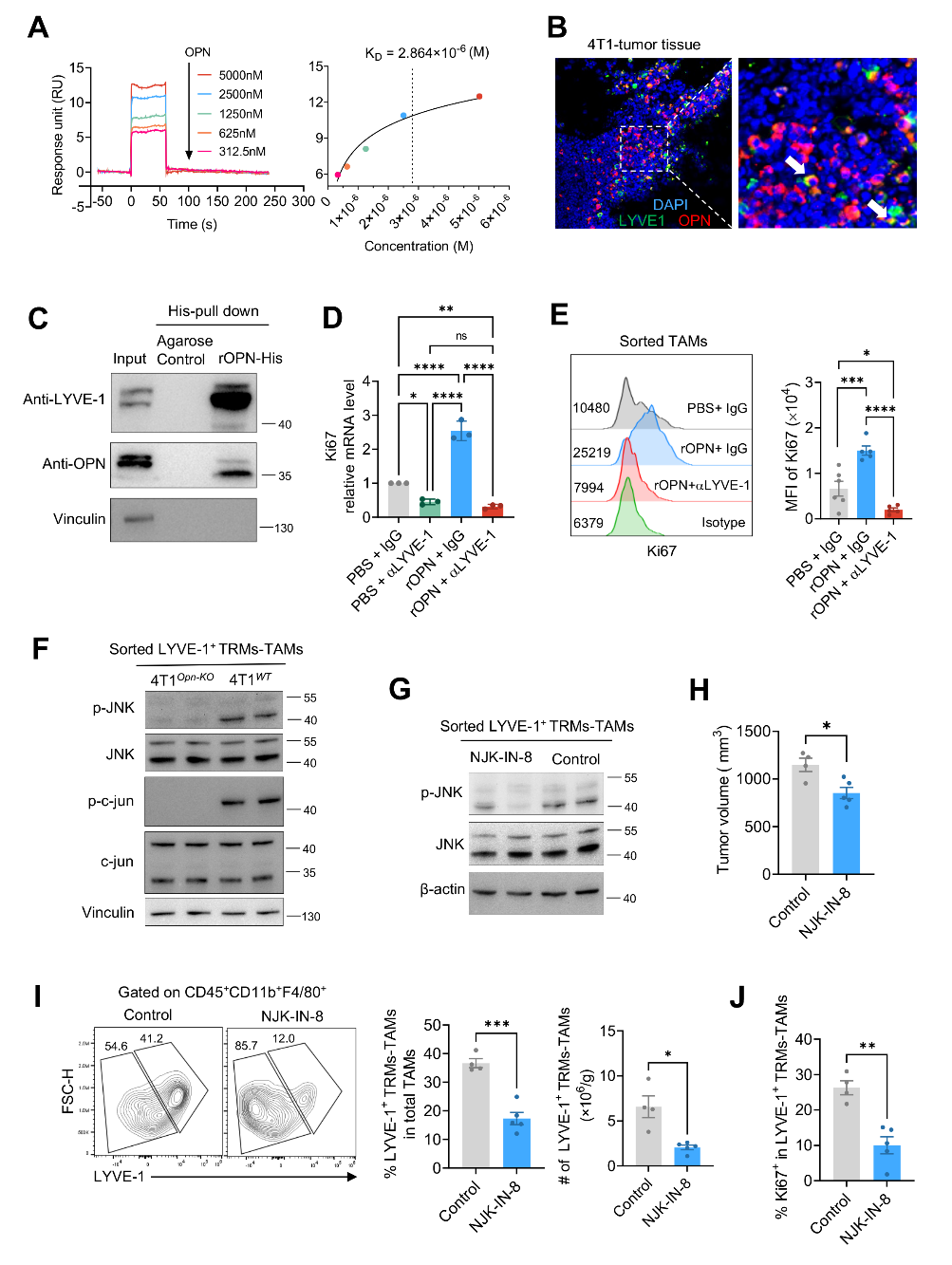
图五:OPN通过与LYVE-1结合激活JNK/c-jun促进LYVE-1+TRM-TAMs增殖
在详细阐述OPN通过不同机制调控肿瘤组织中LYVE-1+TRM-TAMs和LYVE-1-MDM-TAMs的基础上,作者进一步探讨两个TAM亚群在肿瘤进展中的作用以及OPN在其中的作用。结果表明LYVE-1+TRM-TAMs具有高度免疫抑制作用,而LYVE-1-MDM-TAMs可能介导抗肿瘤反应,OPN的促肿瘤效应依赖于TRM-TAM亚群(图六)。
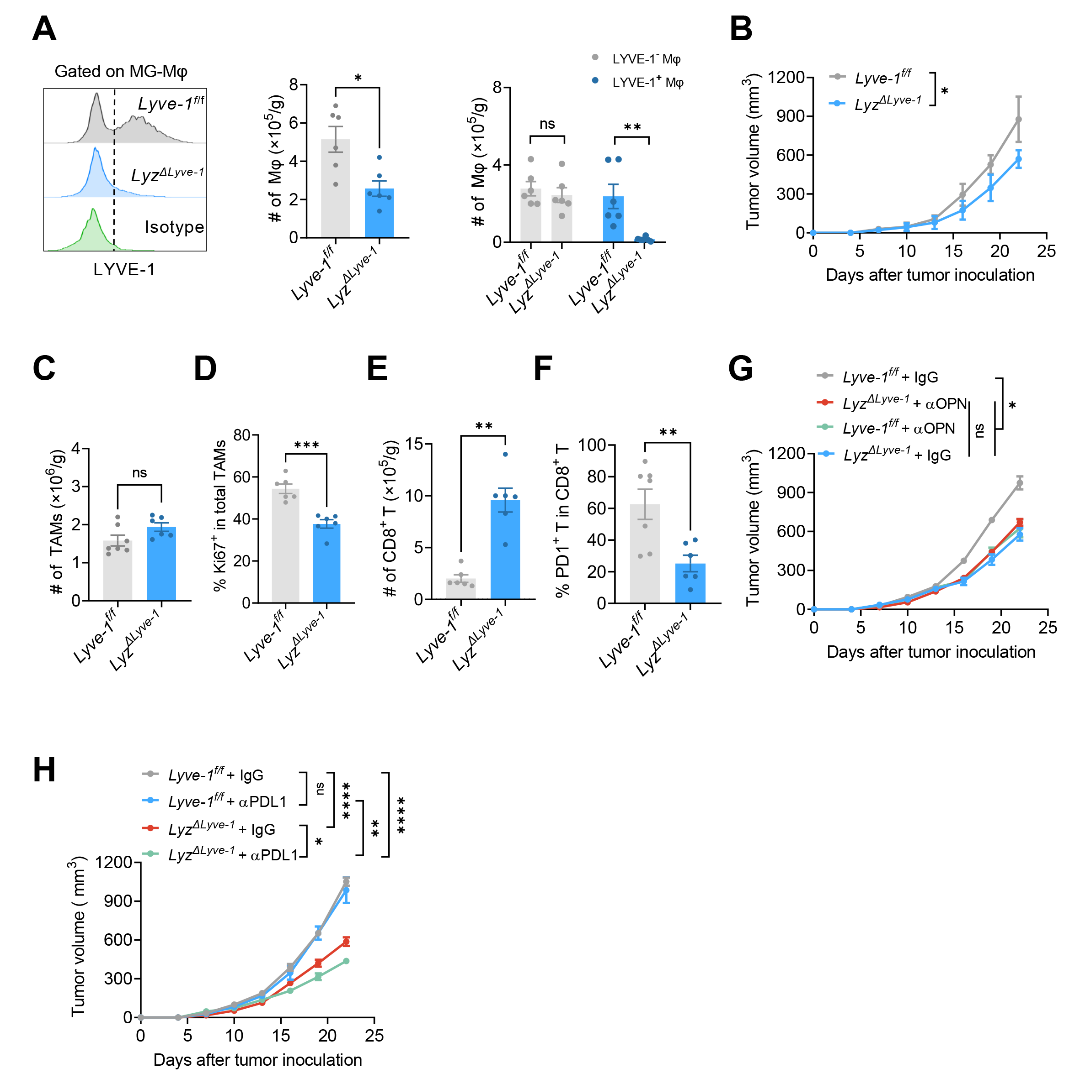
图六:肿瘤来源OPN的促肿瘤效应依赖于TRM-TAM亚群
相关的研究成果近期发表在Cell Rep.上,文章第一作者为吉林大学博士研究生赵磊,通讯作者为吉林大学杨永广教授和刘文涛副教授。
全文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(24)01390-1